【お役立ち翻訳】MDCG 2021-12 欧州医療機器名称(EMDN)に関するFAQ

本記事は2021年5月に発出されたMDCG 2021-12「FAQ on the European Medical Device Nomenclature (EMDN)」(ver.1.1)の翻訳です。ご使⽤の際には適宜、英語原⽂をご参照ください。
本和訳のご使⽤から派⽣するあらゆることがらについて、当社が責任を負うものではないことをご了解の上、本和訳をご使⽤ください。
なお、本和訳に関する誤記の修正等に関する事項にはご対応させていただきますが、解釈等に関しましてはご対応いたし兼ねますことをご承知おきください。
目次
- 1. 欧州医療機器名称(EMDN)とは何か? What is the European Medical Device Nomenclature (EMDN)?
- 2. EMDNはどのように作成されたか?How was the EMDN created?
- 3.EMDNの主要原則は何か?What are the key principles of EMDN?
- 4.EMDNにアクセスするには?How do I gain access to the EMDN?
- 5.EMDNの構造はどのようなものか?How is the EMDN structured?
- 6.どのレベルのEMDNを機器に割り当てるべきか?Which level of the EMDN should I use to assign a term to my device?
1. 欧州医療機器名称(EMDN)とは何か? What is the European Medical Device Nomenclature (EMDN)?
欧州医療機器規制 (MDR, Regulation (EU) 2017/745)第 26 条および欧州体外診断医療機器規制 (IVDR, Regulation (EU) 2017/746)第 23 条により、欧州医療機器名称(EMDN) は、欧州医療機器データベース(EUDAMED)の次の機能をサポートすることを目的としている。そのさまざまな用途の中で、EMDNは、製造業者が EUDAMED に医療機器を登録するために利用され、各機器固有識別子(Unique Device Identifier, UDI)の機器識別子(Device Identifier)(UDIDI) に関連付けられる。
Per Article 26 of Regulation (EU) 2017/745 on medical devices (MDR) and Article 23 of Regulation (EU) 2017/746 on in vitro diagnostic medical devices (IVDR), the European Medical Device Nomenclature (EMDN) aims at supporting the functioning of the European database on medical devices (EUDAMED). Among its various uses, it will be utilised by manufacturers for the registration of medical devices in EUDAMED,
where it will be associated to each Unique Device Identifier – Device Identifier (UDIDI).
EMDN は主に MDR および IVDR の要件をサポートする規制目的を果たすため、MDR/IVDR 機器の文書化および技術文書、NBによって実施される技術文書のサンプリング、市販後調査(PMS)、ビジランスおよび市販後データの分析においても重要な役割を果たす。 これは、MDR/IVDR の下での活動におけるすべての関係者をサポートすることを目的としており、患者自身の機器および市場で入手可能かつ EUDAMED に登録されているその他すべての機器に関して、重要な機器に関する説明を患者に対して提供する。
As the EMDN primarily serves regulatory purposes to support MDR and IVDR requirements, it also plays a key role in MDR/IVDR device documentation and technical documentation, sampling of technical documentation conducted by notified bodies, post-market surveillance, vigilance and post-market data analysis, etc. It is intended to support all actors in their activities under the MDR/IVDR and provides key device descriptions to patients as regards their own devices and all other devices available on the market and registered in EUDAMED.
2. EMDNはどのように作成されたか?How was the EMDN created?
欧州委員会と医療機器調整グループ (MDCG) の EU 規制当局によって定められた基準と要件に従い、MDCG が示した方向性に基づいて、EMDN は、イタリア当局の‘Classificazione Nazionale Dispositivi medici (CND)’を将来のEMDNの基礎として使用することを示す欧州委員会の通知に従って設立された。
当時、CND はすでに 3 つの加盟国 (イタリア、ギリシャ、ポルトガル) で利用されており、さまざまな EU および EU 内の国際的な製造業者の登録をサポートしていた。
According to criteria and requirements set out by the European Commission and EU regulators in the Medical Device Coordination Group (MDCG) and based on orientations provided by the MDCG, the EMDN was founded following a European Commission notice indicating the utilisation of the Italian Ministry’s ‘Classificazione Nazionale Dispositivi medici (CND)’ as the basis for the future EMDN.
At that time, the CND was already utilised in three Member States (Italy, Greece and Portugal) and supported the registrations of a variety of EU and international manufacturers within the EU.
2019 年と 2020 年の間に、CND に関する協議と準備作業を利害関係者や主要な専門家が行った。 EMDN の最初のバージョンは 2021 年 5 月 4 日にリリースされた。
During the course of 2019 and 2020, consultations and preparatory work on the CND took place with stakeholders and key experts. A first version of the EMDN was released on 4 May 2021.
3.EMDNの主要原則は何か?What are the key principles of EMDN?
EMDN は、欧州委員会と EU 規制当局が共同で定めた基本的な重要な原則に基づいている。これらの原則には以下が含まれるが、これらに限定されない。
(a) 規制当局の主導: 規制当局は、名称の管理、バリデート、更新、および助言において重要な役割を果たす。
(b) 構造化: 用語とコードがグループやタイプに有意にクラスタリングできる透過的な階層構造を持つ名称。
(c) 予測可能: 構造と内容が十分に安定しており、技術革新への適応を可能にする方法で、名称のさまざまな規制上の使用を可能にする。
(d) 透明性: 名称の用語と説明の更新に関するポリシーが健全であり、規制当局およびより広範な医療コミュニティのニーズを反映している。
(e) 包括的: 定期的なレビューが、リアルワールドでの使用と実証可能なニーズに基づいて、すべての人に開かれている。
(f) 利用可能: 用語、説明、およびコードは、すべてのユーザーが完全に利用できる。
(g) アクセス可能: 製造者または自然人/法人は、名称の使用に関して、他の事業者と比較して、料金を課されたり、差別を受けたりしてはならない。
(h) 国際的: MDR/IVDR の適用日の時点で国際的に認められている。
The EMDN is based on fundamental key principles jointly set out by the European Commission and EU regulators. These principles include but are not limited to:
(a) Regulators-led: regulators play a key role in managing, validating, updating and advising on the nomenclature.
(b) Structured: the nomenclature has transparent hierarchies by which terms and codes could be meaningfully clustered into groups and types.
(c) Predictable: the structure and content remains sufficiently stable to allow various regulatory uses of the nomenclature, in a manner which still allows for the accommodation of technological innovation.
(d) Transparent: the policies for updates of the nomenclature terms and descriptions are sound and reflect the needs of regulators and the wider healthcare community.
(e) Inclusive: the periodic reviews are open to all, based on real-world use and demonstrable needs.
(f) Available: the terms, descriptions and codes are available, in full, to all users.
(g) Accessible: no manufacturer or natural/legal person should be subject to fee or suffer from any discrimination, compared to other operators, in relation to the use of the nomenclature.
(h) International: internationally recognised at the time of the date of application of the MDR/IVDR.
4.EMDNにアクセスするには?How do I gain access to the EMDN?
EMDNは全体的にすべての利害関係者が無料でアクセスできる。 したがって、製造業者、患者、研究機関、開業医、病院、薬局などの利害関係者の包括的でないリストにおいて利用できる。EMDN は、ここまたは欧州委員会の MDCG の Web サイトページで PDF および Excel 形式でアクセスおよびダウンロードできる。
The entirety of the EMDN is accessible to all stakeholders, free of charge. It can hence be utilised by a non-exhaustive list of stakeholders such as manufacturers, patients, research organisations, practitioners, hospitals, pharmacies etc. The EMDN can be accessed and downloaded in pdf and excel format here and the European Commission’s website page for MDCG documents.
注: 欧州委員会は、2021 年 6 月 4 日を期限として、英語版の European Medical Device Nomenclature (EMDN) に関する 1 か月間のオンライン協議を開催した。その目的は、翻訳エラーや構文の提案について、ユーザーや幅広いヘルスケア コミュニティからフィードバックを収集することであった。提供されたコメントの処理の後、EMDN の第 2版が 2021 年第 3 四半期にリリースされる。さらに、医療機器ソフトウェア (カテゴリ J、W、および Z) の新しい用語と説明が第 2 リリースで公開される予定である。
Note: The European Commission held a month-long online consultation on the English version of the European Medical Device Nomenclature (EMDN) with a deadline of 4 June 2021. The aim was to collect feedback from users and the wider healthcare community on any translation errors and or syntax suggestions. Following the processing of the comments provided, the second version of EMDN will be released in Q3 2021. In addition, new terms and descriptions for medical device software (under Categories J, W and Z) will be rolled-out in the second release.
5.EMDNの構造はどのようなものか?How is the EMDN structured?
EMDN は、7 つのレベルの階層ツリーで確立された英数字構造が特徴であり、医療機器を次の3つの主要なレベルに分類する。
・カテゴリー:最初の階層レベル
・グループ:2 番目の階層レベル
・タイプ:第 3 階層レベル 。(必要に応じて詳細のいくつかのレベル (1°、2°、3°、4°、5°) に展開される)
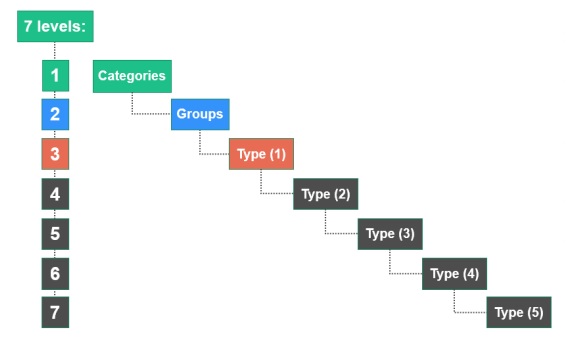
The EMDN is characterised by its alphanumeric structure that is established in a seven-level hierarchical tree. It clusters medical devices into three main levels:
• Categories: the first hierarchical level,
• Groups: the second hierarchical level,
• Types: the third hierarchical level (which expands into several levels of detail (1°, 2°, 3°, 4° and 5°), where necessary.
各英数字コードは、デバイスが該当する「CATEGORY(カテゴリー)」を指す文字で始まり、その後に「GROUP(グループ)」を示す2つの数字と「TYPE(タイプ)」を指す一連の数字が続く。 最大桁数は 13 桁に設定されている。

Each alphanumeric code begins with a letter referring to the ‘CATEGORY’ for which the device falls under, followed by two numbers indicating the ‘GROUP’ and a series of numbers which refer to the ‘TYPE’. The maximum number of digits is set at 13.
6.どのレベルのEMDNを機器に割り当てるべきか?Which level of the EMDN should I use to assign a term to my device?
EMDN のツリー状の階層を使用し、ユーザーは常に利用可能な最も詳細で最終的な用語 (ツリーの最下位レベル) を機器に割り当てる必要がある。
Using the tree-like hierarchy of EMDN, users must always assign the most granular and terminal term available (lowest level in the tree) to their device
