医薬品の製造業者における製造・品質管理体制について(事務連絡)が発出

厚生労働省は令和4年1月31日付で「医薬品の製造業者における製造・品質管理体制について」と題する事務連絡を発出しました。
医薬品の製造業者における人員の確保に係る要求事項
医薬品の製造業者における人員の確保はGMP省令第6条第3項に以下のように規定されています。
(職員)
第六条
(略)
3 製造業者等は、製造・品質関連業務を適切に実施しうる能力を有する人員を十分に確保しなければならない。
GMP省令(医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令)
一方で、昨今発生している品質問題の原因の1つとしては、製造所において適正な人員配置がなされていなかったということが挙げられています。
そのため、日本製薬団体連合会が傘下の会員企業にアンケートを実施した結果を踏まえ策定された「製造所における人員確保の考え方について」を厚生労働省を通じて事務連絡の形で発出することとなりました。
製造業者が製造品目数、製造量等に見合った製造・品質管理体制が確保しているかどうかについては、医療用後発医薬品の承認審査時に行われる適合性調査において確認されます。(根拠:「医療用後発医薬品の承認審査時における新たな対応について」(令和3年7月2日付け薬生薬審発 0702 第5号、薬生監麻発 0702 第5号厚生労働省 医薬・生活衛生局医薬品審査管理課長、監視指導・麻薬対策課長連名通知))
今回の事務連絡を参考に人員体制を確認・見直しすることが求められています。
医薬品製造所における人員確保の考え方
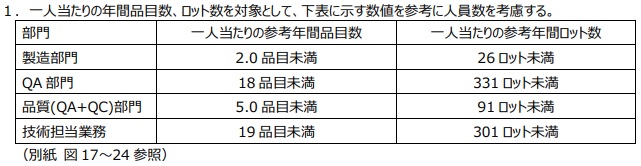
「医薬品の製造業者における製造・品質管理体制について」では製造・品質関連業務に従事する人員(非正規社員を含む)について、
- 製造部門
- 品質保証(QA)部門
- 試験検査(QC)部門
- 技術担当(製造、試験、設備の変更及び設備の維持管理に関わる担当等)業務
の4つに分類し、1人当たり担当する年間品目数・ロット数の参考値を示しています。
また、上記4分類の総人員数に占める品質部門(QA+QC)及びQA部門の人員の参考比率も示されています。
詳しくは「医薬品の製造業者における製造・品質管理体制について」本文をご確認ください。