【お役立ち翻訳】Unique Device Identifier (UDI)の形式および内容【FDAガイダンス】

本記事は2021年7月7日に発出されたFDAガイダンス文書「Unique Device Identification System: Form and Content of the Unique Device Identifier (UDI)」の翻訳です。ご使⽤の際には適宜、英語原⽂をご参照ください。
本和訳のご使⽤から派⽣するあらゆることがらについて、当社が責任を負うものではないことをご了解の上、本和訳をご使⽤ください。
なお、本和訳に関する誤記の修正等に関する事項にはご対応させていただきますが、解釈等に関しましてはご対応いたし兼ねますことをご承知おきください。
Ⅰ. Introduction 導入
本文書は、21 CFR 801.40に基づく特定の要件のFDAの解釈を明確にすることを含め、ラベラーおよびFDA認定の発行機関が一意のデバイス識別子(UDI)のラベリング要件に準拠するのを支援することを目的としている。具体的には、本ガイダンスでは、UDIの発行システムの下で開発されたUDIがUDI System最終規則、78 FR 58786(2013年9月24日)(UDI Rule)の目的を確実に満たすようにするための、UDIの形式と内容に関するFDAの推奨事項について説明する。
本ガイダンス文書全体を通して、「we」、「us」、および「our」という用語は、機器および放射線健康センター(CDRH)および生物製剤評価研究センター(CBER)のFDAスタッフを指す。
本文書の内容は、法律の効力および影響力を持たず、契約に具体的に組み込まれていない限り、いかなる方法でも公衆を拘束することを意図していない。 本文書は、法律に基づく既存の要件に関して一般の人々に明確さを提供することのみを目的としている。本ガイダンスを含むFDAガイダンス文書は、特定の規制または法定要件が引用されていない限り、推奨事項としてのみ見なされるべきである。FDAのガイダンスで「すべき(should)」という言葉を使用することは、何かが提案または推奨されているが、必須ではないことを意味する。
Ⅱ. Background 背景
UDI規則では、例外または代替案が適用されない限り、すべての医療機器のラベルおよび包装にUDIを付ける必要がある。(21 CFR 801.20)さらに、一部の機器は、機器を複数回使用し、使用するたびに再処理することを目的としている場合、機器自体にUDIを提供する永続的なマーキングを付ける必要がある(21 CFR801.45)。
UDI規則には、機器として規制されているスタンドアロンソフトウェアの特別なラベル付け要件も含まれている(21 CFR801.50)。
UDI規則は、流通および使用をとおして機器を適切に識別する医療機器の標準化された識別システムを作成することを目的としている。
UDI規則の前文で述べたように、このシステムは、機器と、その安全で効果的な使用に影響を与えるいくつかの重要な属性を迅速かつ明確に識別することを可能にする(78 FR58786)。
UDI規則では、各ラベラーは、FDA認定の発行機関が運営する1つ以上のシステムを使用して、機器のラベル、機器の包装、および該当する場合は機器自体に直接マーキングとして表示されるUDIを割り当てる必要がある(21 CFR 801.20、 801.45、および830.20)。効果的な識別システムが存在するためには、FDA認定の発行機関が、UDIを割り当てるためのシステムを開発および運用し、これらのシステムを使用するラベラーがUDIラベリング要件に準拠できるようにすることが不可欠である。
UDIは、機器のラベルおよび機器の包装に2つの形式で表示する必要がある。
(1)読みやすいプレーンテキスト。 そして
(2)自動識別およびデータキャプチャ(AIDC)テクノロジー(21 CFR 801.40(a))。
機器に直接マーキングとしてUDIを付す必要がある場合、UDIは、読みやすいプレーンテキストおよびAIDCテクノロジーの形式のいずれか、または両方、または機器のUDIをオンデマンドで提供する代替テクノロジーによって提供できる(21 CFR 801.45 (c))。
Ⅲ. Scope 範囲
本ガイダンスでは、UDIの2つの形式について説明し、UDIの内容を明確にし、UDI内の特定のデータ要素を識別するデータ区切り文字の使用について説明する。 本ガイダンスでは、UDIキャリアの読みやすいプレーンテキスト形式のデータの推奨順序についても説明する。
本ガイダンスは、Universal Product Code(UPC)には適用されない。クラスIデバイスの場合、UPCは21 CFR 801.20(21 CFR 801.40(d))の要件を満たすためのUDIとして機能する場合がある。ただし、クラスIデバイスラベラーは、UPCではなくUDIを使用することを選択できる(21 CFR 801.35を参照)。UPCの詳細については、ラベラーはUPCの発行者にコンタクトをとる必要がある。
ラベラーは、UPCの割り当てを適切にコントロールし、UDIシステムの目標を前進させるために使用する必要がある。
Ⅳ. Unique Device Identifier (UDI) 一意の機器識別子(UDI)
「一意のデバイス識別子」とは、「[21 CFR 830.20]の要件を満たすことにより、流通および使用を通じてデバイスを適切に識別する識別子」と定義される(21 CFR 801.3)。 UDIは、デバイス識別子(DI)と製造識別子(PI)で構成される。
「デバイス識別子」は、「デバイスの特定のバージョンまたはモデルとそのデバイスのラベラーを識別するUDIの必須の固定部分」(21 CFR 801.3)と定義される。
「製造識別子」は、21 CFR 801.3によりこのように定義されている「デバイスのラベルに含まれている場合に、次の1つ以上を識別するUDIの条件付き可変部分:
(i) デバイスが製造されたロットまたはバッチ:
(ii) 特定のデバイスのシリアル番号;
(iii) 特定のデバイスの有効期限;
(iv) 特定のデバイスが製造された日付;
(v) デバイスとして規制されているHCT / Pの場合、この章の21 CFR 1271.290(c)で要求される個別の識別コード」
21 CFR 830.20の下では、UDIは、FDA認定の発行機関が運営するシステムの下で発行され、21 CFR830.10のUDI規則に参照として組み込まれている次の国際規格に準拠している必要がある:
- ISO / IEC 15459-2:情報技術-自動識別及びデータ収集技術-同定識別子-第2部:登録手順;
- ISO/IEC 15459-4:情報技術-一意の識別子-第4部:個々のアイテム
- ISO/IEC 15459-6:情報技術-一意の識別子-第6部:製品グループの一意の識別子
さらに、UDIは、ISO / IEC646:情報技術-情報交換用のISO7ビットコード化文字セットの不変文字セットの文字および数字のみを使用する必要がある。
FDA認定の各発行機関が、21 CFR Part 801 Subpart Bに基づくUDIラベリング要件と一致するUDIの割り当てシステムを開発および運用し、ラベラーがFDA認定の発行機関のシステムを、自信を持って使用してこれらの要件を満たすUDIを割り当てることができるようにすることが重要である。
A. Forms of UDI UDIの形式
UDI規則では、機器のラベルと機器の包装のUDIは、読みやすいプレーンテキストとAIDCテクノロジー形式の両方で提示する必要があると指定されている(21 CFR801.40(a))。
さらに、特定のデバイスは21 CFR801.45によって直接マークする必要がある。これらのデバイスの場合、デバイス自体に直接マークされたUDIは、読みやすいプレーンテキストまたはAIDCテクノロジー、あるいはデバイスのUDIをオンデマンドで提供する代替テクノロジーのいずれかまたは両方によって提供することができる(21 CFR 801.45(c))。
UDIは、特にAIDCテクノロジーを通じて提供される場合、迅速かつ正確なデータの取得、記録、および取得を可能にすることを目的としている。 読みやすいプレーンテキスト形式により、医療の専門家、患者、FDA、およびUDIシステムの他のユーザーは、技術支援なしでUDIを読み取り、患者の記録やFDAへのレポートなどのデータシステムに入力できる。
したがって、AIDC形式を使用できない場合は、UDIをキャプチャするための追加のメカニズムとして、読みやすいプレーンテキスト形式が使用され得る。 図1は、読みやすいプレーンテキスト形式とAIDC形式の両方のUDIの例を示している。
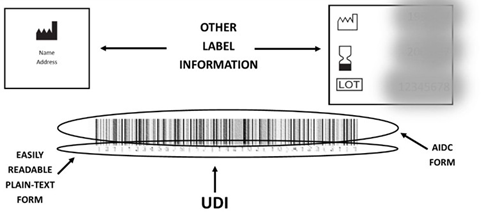
1. Easily readable plain-text 読みやすいプレーンテキスト
本ガイダンスでは、「読みやすいプレーンテキスト」とは、UDIデータ文字の人間が判読できる解釈を意味する。 発行機関またはその他の組織では、UDIの読みやすいプレーンテキスト形式を人間が読める形式の解釈(HRI)と呼ぶ場合がある。
読みやすいプレーンテキスト形式のUDIには、DIと、該当する場合はPIが含まれている必要がある。 データ区切り文字が含まれていない場合、個人は、読みやすいプレーンテキスト形式のUDIを使用してデバイスを識別できない可能性がある。 読みやすいプレーンテキスト形式のUDIは、1行または複数行のテキストとして表示される場合があり、UDIのAIDCテクノロジー形式の下または近くに表示する必要がある。
FDAは、UDIのPI部分の日付の形式を規定しておらず、日付が含まれている場合、21 CFR801.18に準拠するためのUDIの読みやすいプレーンテキスト形式を要求していない。 UDI内の日付の形式に関する質問については、FDA認定の発行機関に問い合わせるか、FDA認定の発行機関に問い合わせること。
2. AIDC
AIDCは、21 CFR 801.3において、自動化されたプロセスを介して電子的な患者記録または他のコンピューターシステムに入力できる形式によってデバイスのUDIまたはUDIのDI部分を伝達するテクノロジーとして定義されている。 したがって、UDIルールではUDIを伝達するために特定の形式のAIDCまたは特定のAIDCテクノロジーを使用する必要はないが、UDIのAIDC形式は、バーコードスキャナーまたは他のAIDCテクノロジーで読み取れる形式である必要がある。(21 CFR 801.3および801.40(a))。
ラベラーは、デバイス識別情報を取得することが重要な流通および使用中の時点において、AIDC形式のUDIを確実に読み取ることができるようにする必要がある。 ラベラーは、FDA認定の発行機関のガイドラインを参照して、発行機関のUDIシステムでサポートされているAIDCの形式を決定する必要がある。
可能であれば、FDAはUDIのAIDC形式を1つのセグメントに表示することを推奨している。 ただし、複数のセグメントに分割される場合がある。たとえば、1つのUDIが2つの線形バーコードで表示される場合がある。1つはDIセグメント用のバーコードで、もう1つはPIセグメント用のバーコードである。 これらの2つのバーコードは、機器のラベル、機器の包装、および必要に応じてデバイス自体で互いに近接している必要がある。
ラベラーは、単一の機器のラベル、機器の包装、またはデバイス(該当する場合)で複数のタイプのAIDCテクノロジーを使用して、UDIキャプチャテクノロジーの異なった方法を採用している可能性のあるユーザーを支援することを選択できる。 たとえば、ラベラーは、デバイスラベルに線形(1-D)バーコードとデータマトリックスコード(2-D)を含めることができ、どちらも同じUDIを表す。 この例では、UDIの1つである読みやすいプレーンテキスト形式のみが機器のラベル(21 CFR 801.40(a))にある必要があり、UDIのAIDC形式の1つに近接している必要がある。
ラベラーがバーコード形式のAIDCを選択した場合、バーコード形式のUDIの印刷品質をテストする必要がある。 FDAは、印刷品質の決定に関する詳細について、次の規格および技術参照を参照することを推奨する:
- ISO/IEC 15416:情報技術-自動識別およびデータキャプチャ技術-バーコードシンボル印刷品質評価仕様-一次元シンボル;
- ISO/IEC 15415:情報技術-自動識別およびデータキャプチャ技術-バーコードシンボル印刷品質評価仕様-二次元シンボル;および
- ISO/IEC TR 29158: 情報技術-自動識別およびデータキャプチャ技術-ダイレクトパーツマーク(DPM)の品質ガイドライン
21 CFR 801.40(c)は、UDIの伝達に使用されるAIDCテクノロジー形式(RFIDテクノロジーなど)が機器のラベルまたは機器の包装の目視検査で明らかでない場合、機器のラベルまたは機器の包装はAIDCテクノロジーの存在を明らかにしなければならない旨を規定している。
FDAは、目視検査では明らかではないAIDCテクノロジーの存在を明らかにするための特定の種類のシンボルを要求していない。ただし、FDAは、21 CFR 801.15(c)と一致している場合、国際的に認められているシンボルの使用を検討することをラベラーに推奨している。
B. Content of UDI UDIの内容
本ガイダンスの目的のため、FDAは「UDIキャリア」を、読みやすいプレーンテキストおよび/またはAIDC形式を使用してUDIおよび潜在的な非UDI要素を伝達する手段として定義する。
UDIキャリアには、デバイスに関する追加の非UDI情報が含まれる場合がある。 たとえば、一部のFDA認定発行機関は、UDIキャリア内のデータ文字列に数量などの非UDI要素を含めることを規定している場合がある。
ただし、FDAは、そのような追加の非UDI要素をUDIの一部であるとは見なしていない。
そのため、追加の非UDI要素のデータ区切り文字は、UDIのDIおよびPIデータ区切り文字とは異なる必要がある。
21 CFR 801.40(b)においては、UDIの読みやすいプレーンテキストおよびAIDC形式には次のものが含まれている必要がある:
(1)デバイス識別子セグメント;および
(2)機器のラベルに含まれている場合、21 CFR801.3の「製造識別子」の定義に列挙されている1つ以上の識別子を伝達する製造識別しセグメント。
デバイス識別子セグメントおよび製造識別子セグメントに、非UDI要素または非UDI要素のデータ区切り文字を含めることはできない。
UDI規則においては、PIを構成する5つの識別子のいずれもラベルに記載する必要はない。 ただし、他の規制では、PIを構成する1つ以上の識別子をラベルに記載する必要がある場合がある。
たとえば、21 CFR 1271.290(c)の下では、ヒトの細胞、組織、細胞および組織を用いた製品(HCT / P)の製造業者は、HCT / Pに個別の識別コードを割り当ててラベルを付ける必要がある。
さらに、ラベラーが、ラベル上にPIを構成する識別子のいずれかを含む場合、クラスIデバイス以外のUDIを保持する必要があるすべてのデバイスについて、当該識別子はUDIのPIセグメントにも含まれている必要がある( 21 CFR 801.30(d)および801.40(b))。
UDIがDIのみで構成されている場合がある。 たとえば、クラスIIデバイスのラベル上にPIを構成する5つの識別子のいずれも含まれていない場合、PIはUDIでは必要ない。
さらに、クラスIデバイスのUDIには、PIを含める必要はない(21 CFR801.30(d))。 ただし、クラスIデバイスのラベラーは、UDIにPIを自発的に含めることができる。
C. Data delimiters データ区切り文字
本ガイダンスの目的のために、「データ区切り文字」とは、UDIキャリアで表されるエンコードされたデータ文字列内の特定のデータ要素を識別する定義済みのデータ文字またはデータ文字のセットのことを意味する。
データ区切り文字は、その直後に続く情報を識別するために使用される。
データ区切り文字は、FDA認定の各発行機関によって確立されたUDIシステムによって異なる。
データ区切り文字は、UDIの理解可能性と有用性の鍵である。
データ区切り文字は、UDIキャリアで表されるデータ文字列内の各データ要素を示して区別する。
データ区切り文字を含めることは、UDIの読みやすいプレーンテキスト形式とAIDC形式の両方にとって重要である。データ区切り文字を使用すると、ユーザーはDIとPIをUDIの読みやすいプレーンテキスト形式で解析したり、UDIのAIDC形式でエンコードされた情報がUDIの読みやすいプレーンテキスト形式と一致することを確認したりできる。
データ区切り文字を使用すると、スキャン後にUDIを電子システムに解析することもできる。 重要なことは、データ区切り文字を使用すると、UDIキャリアで表される可能性のある非UDI要素とは別にUDIを区別してキャプチャできることである。
さらに、非UDI要素がUDIキャリアに含まれている場合は、これらの非UDI要素の個別のデータ区切り文字を含める必要がある。
非UDI要素を識別するための適切なデータ区切り文字がなければ、人はUDIの読みやすいプレーンテキスト形式を使用してデバイスを識別できず、コンピューターシステムは自動化されたプロセスを介してAIDC形式でUDIを正確にキャプチャできない可能性がある。
D. Order of the data represented in the easily readable plaintext form of UDI carrier 読みやすいプレーンテキスト形式のUDIキャリアで表されるデータの順序
読みやすいプレーンテキスト形式のUDIキャリアでは、UDIを非UDI要素の前に置く必要がある。読みやすいプレーンテキスト形式のUDIは、最初にDIを指定し、次にPI(存在する場合)を指定するように配置する必要がある。
UDIキャリアに非UDI要素がある場合、非UDI要素は、読みやすいプレーンテキスト形式でUDIの一部であるPIの後に続く必要がある。
たとえば、特定のデバイスのラベルに有効期限と数量が記載されており、ラベラーがUDIキャリアに数量を含めたい場合、UDIキャリアの読みやすいプレーンテキストに、DIに続いてDIのデータ区切り文字を表示する必要がある;有効期限のデータ区切り文字およびそれに続く有効期限PI;最後に、数量のデータ区切り文字の後に数量が続く。
FDAはUDIキャリアに数量を含めることを禁止していないが、数量はUDIの一部とは見なされず、数量のデータ区切り文字はUDIのDIおよびPIデータ区切り文字とは異なる必要がある。特定の非UDI要素をUDIキャリアに含める方法の詳細については、ラベラーはFDA認定の発行機関のガイドラインを参照するか、FDA認定の発行機関に問い合わせる必要がある。
E. StandAlone Software スタンドアロンソフトウェア
パッケージ形式(21 CFR 801.50)で流通するかどうかによって、スタンドアロンソフトウェアのラベル付け要件は異なる。 パッケージ形式で流通しないスタンドアロンソフトウェアの場合、UDIが次のいずれかまたは両方を介して提供され、バージョン番号がPIで伝達された場合に、UDIラベル付け要件が満たされる:
- ソフトウェアが起動するたびに表示される、読みやすいプレーンテキストステートメント。;または
- メニューコマンド(「about」コマンドなど)を介して表示される、読みやすいプレーンテキストステートメント(21 CFR 801.50(a))。
パッケージ形式で流通するスタンドアロンソフトウェアの場合、21 CFR 801.50(a)は適用されない。当該 スタンドアロンソフトウェアは、ソフトウェアの起動時またはメニューコマンド(21 CFR 801.50(b))を介して表示される、読みやすいプレーンテキストステートメントとしてUDIを提供する必要がある。
さらに、機器のラベルおよび包装には、読みやすいプレーンテキスト形式およびAIDC形式の両方のUDIが含まれている必要がある(21 CFR 801.20(a)および801.40(a))。 上述の説明のように、デバイスが製造されたロットまたはバッチが機器のラベルに含まれている場合、ロットまたはバッチがPIに含まれている必要がある(21 CFR 801.3および801.40(b))。
「ソフトウェアバージョン」は、21 CFR801.3のロットまたはバッチの定義に含まれている。したがって、UDIを保持するために必要なスタンドアロンソフトウェアのラベラーがラベルにソフトウェアバージョンを含む場合、それはPIを介して伝達される必要がある(21 CFR 801.3、801.50(b; 78 FR 58794も参照)。
おわりに
この記事ではFDAのUDIの内容および形式に関するガイダンス文書を紹介いたしました。
UDIは米国のみならず、EUでも今後対応が必須となります。
EUのUDIに関するガイダンスは下記をご覧ください。

